L’espèce humaine présente des capacités d’apprentissage accrues, comparé aux autres espèces de Mammifères, dont les autres primates. Ceci repose en partie sur la lenteur du développement de notre cerveau, et en partie de la formation des synapses – les connexions entre les neurones. On appelle ce phénomène la néoténie synaptique : notre cerveau reste immature pendant des années. Trois études récentes, par des laboratoires Belges, Américains et Français, publiées dans les journaux Neuron et Cell Reports, apportent un regard nouveau sur ce phénomène, et découvrent des mécanismes moléculaires propres à notre espèce, faisant le lien entre l’évolution de la lignée humaine et certains troubles neuro-développementaux, comme la déficience intellectuelle.
Néoténie synaptique, plasticité cérébrale et apprentissage chez Homo sapiens
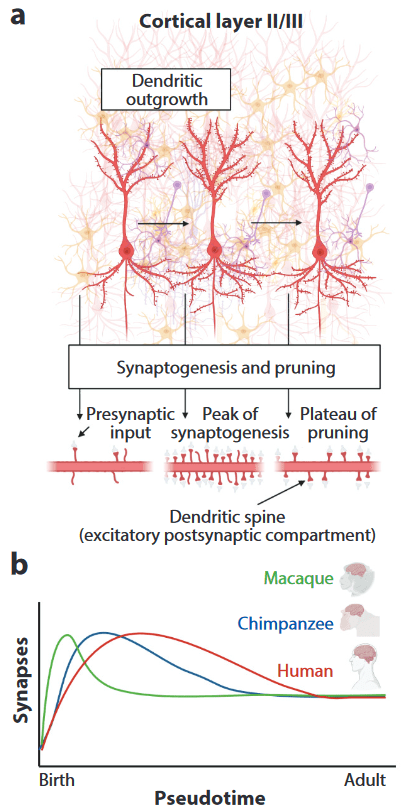
Comparé aux cerveaux d’autres primates, le cerveau humain reste immature plus longtemps. On appelle cela la néoténie. Les neurones du cortex cérébral présentent des protubérances qu’on appelle des épines dendritiques, qui contiennent les synapses – les connexions entre les neurones (Figure 1A et image chapeau). A la naissance, les nouveaux-nés n’ont quasiment pas d’épines dendritiques, puis le nombre augmente pour atteindre un maximum : cette période est la synaptogenèse. Puis, les épines dendritiques deviennent moins nombreuses, plus grosses et moins mobiles : les connexions synaptiques se stabilisent (Figure 1A).
Chez l’humain, la synaptogenèse dans le cortex cérébral préfrontal (partie à l’avant du cerveau, impliquée dans le contrôle des émotions, l’abstraction, la réflexion) s’étend au cours de nos 5 à 10 premières années, contre 1 an chez le macaque et 1 mois chez la souris (Figure 1B) ! Cet allongement de la période de plasticité cérébrale chez l’humain induit une période de grande plasticité cérébrale. Grâce à cela, l’humain apprend plus de choses et pendant plus longtemps. Heureusement, cela correspond à la période où nous sommes sur les bancs de l’école. Il faut attendre environ la quarantaine pour que le cerveau mature complètement !
Les neurones corticaux humains sont intrinsèquement plus lents à se développer
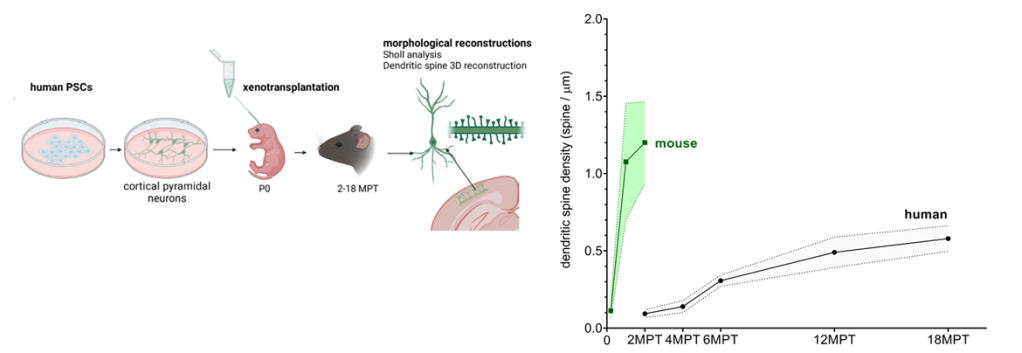
Des études précédentes ont montré que cette lenteur est intrinsèque aux neurones humains. Pour ce faire, les chercheurs avaient différencié des cellules souches humaines en neurones humains qu’ils avaient greffés dans le cortex cérébral de souris : les neurones humains se sont développés à leur rythme, alors que le cerveau de souris mature très vite. Cela a été confirmé au niveaux des synapses dans un des nouveaux travaux en question (Figure 2).
Le fait que « l’horloge » soit intrinsèque aux neurones humains permet d’en étudier les mécanismes sous-jacents. C’est ce qu’on fait trois études publiées en 2024 dans les journaux scientifiques Neuron et Cell Reports. Ces travaux sont le fruit de collaborations entre des laboratoires de l’Université de Leuven (KU Leuven) et du VIB (Vlaams Instituut voor Biotechnologie) en Belgique, de l’Université de Columbia aux États-Unis et de l’École normale supérieure (Paris) en France. Ils correspondent pour certains à 7 ans de mon travail de recherche post-doctoral à la KU Leuven et au VIB, dans le laboratoire de Pierre Vanderhaeghen.
Les gènes spécifiques à l’humain SRGAP2B et SRGAP2C sont nécessaires à la néoténie synaptique
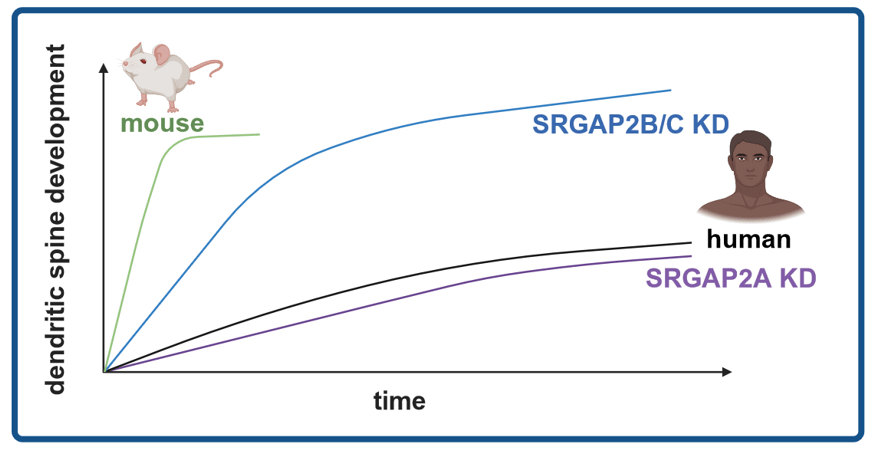
Un des mécanismes moléculaires évolutifs est la duplication de gène. Par ce mécanisme, l’espèce humaine a acquis de nouveaux gènes, non présents chez les autres primates. Cela concerne environ 53 familles de gènes. On parle de gènes spécifiquement humains. Deux autres gènes spécifiquement humains s’appellent SRGAP2B et SRGAP2C. Ces gènes sont apparus, respectivement, il y a 3,4 et 2,4 millions d’années, soit à l’époque des australopithèques (dont la célèbre Lucy !) pour le premier, et d’Homo habilis (celui qui aurait inventé l’outil) pour le second (Figure 3). SRGAP2B et SRGAP2C ont été dupliqués à partir d’un gène ancestral, partagé entre les Mammifères : SRGAP2A (Figure 3). De précédentes études ont montré que lorsqu’on exprime SRGAP2B et SRGAP2C dans des neurones de souris, ont ralentit leur développement synaptique et ont augmente les capacités d’apprentissage des souris, deux caractéristiques du cerveau humain (voir le post « Ces gènes qui ont rendu notre cerveau humain« ).

Est-ce le cas chez l’humain ? Pour répondre à cette question, dans un des nouveaux travaux en question, des neurones humains ont été différentiés à partir de cellules souches et xénotransplantés dans le cortex cérébral de la souris. L’expression des gènes SRGAP2B et SRGAP2C a été abolie dans ces neurones, ce qui permet d’en étudier le rôle. Ensuite, le développement des synapses et épines dendritiques a été analysé pendant 18 mois.
Première observation : oui, la perte de fonction des gènes SRGAP2B et SRGAP2C entraîne une accélération de la maturation synaptique (Figure 4). Après 18 mois, on observe des densités dendritiques de la colonne vertébrale similaires à celles observées dans les cortex cérébraux humains âgés de 5/10 ans !
Des mécanismes moléculaires, liés aux troubles neuro-développementaux, spécifiques à l’humain
Seconde question : comment cela fonctionne-t-t’il ? Des expériences de génétique, dans deux des nouveaux travaux en question, chez la souris et dans les neurones humains, ont montré que les gènes SRGAP2B et SRGAP2C sont des modificateurs spécifiques à l’ espèce humaine de voies moléculaires liées aux troubles neuro-développementaux qui régulent la vitesse de maturation synaptique (Figure 5). En effet, les gènes SRGAP2B et SRGAP2C jouent sur un antagonisme moléculaire entre trois protéines synaptiques : SRGAP2A, SYNGAP1 (Figure 5) et CTNND2. Or, SYNGAP1 et CTNND2 sont associés à des troubles neuro-développementaux, tels que la déficience intellectuelle, le spectre autistique et le syndrome du Cri du Chat.
Notamment, un des nouveaux travaux en question montre que les neurones humains mutants pour SYNGAP1 (comme observé chez des patients atteints de déficience intellectuelle) présentent une accélération de leur développement synaptique et une altération des capacités d’apprentissage. Ce travail suggère que la perturbation de la néoténie synaptique est une composante de certains troubles neuro-développementaux. De plus, deux de ces travaux suggèrent une sensibilité propre à notre espèce à des mécanismes moléculaires liés aux troubles neuro-développementaux, à cause des gènes SRGAP2B et SRGAP2C.
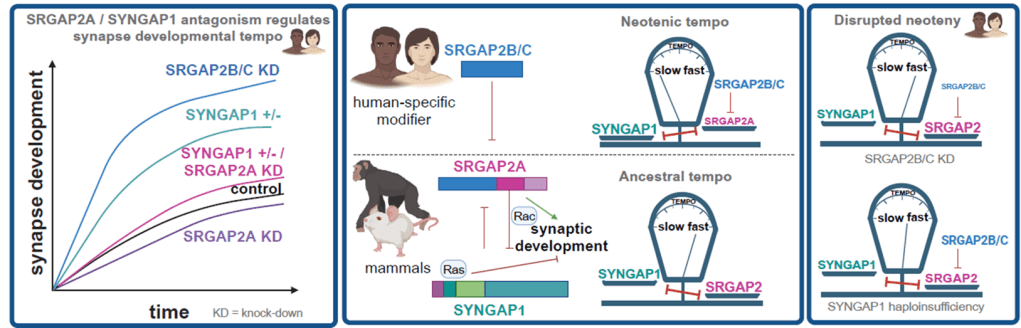
En conclusion, la maturation synaptique des neurones humains est très lente, comparé aux autres espèces de Mammifères. On parle de néoténie synaptique. Cette propriété est intrinsèque aux neurones humains. Un des mécanismes moléculaire implique les gènes spécifiques à l’humain SRGAP2B et SRGAP2C. Ces gènes agissent sur un mécanisme commun aux Mammifères, impliquant des protéines associées à des troubles neuro-développementaux. Ces derniers comprennent une altération de la néoténie et de la plasticité synaptiques. Ces résultats suggèrent une sensibilité propre à notre espèce aux troubles neuro-développementaux, à cause des gènes SRGAP2B et SRGAP2C. Ces travaux n’auraient pas pu être possible sans l’expérimentation animale (modèle de souris), ni l’usage de modèles de différentiation à partir de cellules souches humaines. Enfin, des financements de l’Union Européenne (European Research Council), de la Fondation NOMIS, et d’Agences ou Fondations Belges (le programme EOS/FWO, le FWO, le fonds Generet, la Fondation Médicale Reine Élisabeth), Américaines (NIH) et Françaises (INSERM, CNRS) et ont financé ces travaux.
Plus sur ces découvertes :
https://www.levif.be/societe/sante/decouverte-dune-nouvelle-interaction-genetique-liee-a-lautisme/
Références :
- Libé-Philippot B, Iwata R, Recupero AJ, Wierda K, Bernal Garcia S, Hammond L, van Benthem A, Limame R, Ditkowska M, Beckers S, Gaspariunaite V, Peze-Heidsieck E, Remans D, Charrier C, Theys T, Polleux F, Vanderhaeghen P. (2024) Synaptic neoteny of human cortical neurons requires species-specificbalancing of SRGAP2-SYNGAP1 cross-inhibition, Neuron. 2024 Oct https://doi.org/10.1016/j.neuron.2024.08.021. Cet article montre que la néoténie synaptique est intrinsèque aux neurones humains. Il montre le rôle des gènes SRGAP2B et SRGAP2C dans la néoténie synaptique des neurones humains. C’est la première étude montrant le rôle de gènes spécifiques à l’humain, dans le développement de neurones humains. Ce travail révèle le lien des protéines SRGAP2 avec SYNGAP1, impliqué dans la déficience intellectuelle et le spectre autistique.
- Vermaercke B, Iwata R, Wierda K, Boubakar L, Rodriguez P, Ditkowska M, Bonin V, Vanderhaeghen P. (2024) SYNGAP1 deficiency disrupts synaptic neoteny in xenotransplanted human cortical neurons in vivo. Neuron. 2024 Sep 25;112(18):3058-3068.e8. Cet article montre que des mutations pathologiques du gène SYNGAP1, observées chez des patients avec déficience intellectuelle et spectre autistique, perturbent la néoténie synaptique humaine et altèrent les capacité d’apprentissage des réseaux neuronaux. C’est une étude majeure montrant le lien entre néoténie synaptiques et apprentissage.
- Assendorp N, Fossati M, Libé-Philippot B, Christopoulou E, Depp M, Rapone R, Dingli F, Loew D, Vanderhaeghen P, Charrier C. (2024) CTNND2 regulation by the SRGAP2 protein family links human evolution to synaptic neoteny, Cell Reports 202443, 114797, October 22, 2024. Cet article montre révèle le lien des protéines SRGAP2 avec SYNGAP1 et CTNND2, impliquée dans la déficience intellectuelle et le syndrome du Cri du Chat. Il montre que CTNND2 contrôle la vitesse de maturation synaptique, dans les neurones de souris et humains.
- Libé-Philippot B & Vanderhaeghen P. (2021) Cellular and molecular mechanisms linking human cortical development and evolution, Annual Review of Genetics, Vol. 55, 2021
- Schmidt ERE, Zhao HT, Park JM, Dipoppa M, Monsalve-Mercado MM, Dahan JB, Rodgers CC, Lejeune A, Hillman EMC, Miller KD, Bruno RM, Polleux F. (2021) A human-specific modifier of cortical connectivity and circuit function. Nature. 2021 Nov;599(7886):640-644
- Linaro D, Vermaercke B, Iwata R, Ramaswamy A, Libé-Philippot B, Boubakar L, Davis BA, Wierda K, Davie K, Poovathingal S, Penttila PA, Bilheu A, De Bruyne L, Gall D, Conzelmann KK, Bonin V*, Vanderhaeghen P. (2019) Xenotransplanted Human Cortical Neurons Reveal Species-Specific Development and Functional Integration into Mouse Visual Circuits, Neuron 2019 Dec 4;104(5):972-986.e6
- Suzuki IK, Gacquer D, Van Heurck R, Kumar D, Wojno M, Bilheu A, Herpoel A, Lambert N, Cheron J, Polleux F, Detours V, Vanderhaeghen P. (2018) Human-Specific NOTCH2NL Genes Expand Cortical Neurogenesis through Delta/Notch Regulation. Cell. 2018 May 31;173(6):1370-1384.e16
- Forrest, M.P., Parnell, E., and Penzes, P. (2018). Dendritic structural plasticity and neuropsychiatric disease. Nat Rev Neurosci 19, 215–234.
- Sherwood, C.C., and Gómez-Robles, A. (2017). Brain Plasticity and Human Evolution. Annu Rev Anthropol 46, 399–419.
- Charrier C, Joshi K, Coutinho-Budd J, Kim JE, Lambert N, de Marchena J, Jin WL, Vanderhaeghen P, Ghosh A, Sassa T, Polleux F. (2012) Inhibition of SRGAP2 function by its human-specific paralogs induces neoteny during spine maturation. Cell. 2012 May 11;149(4):923-35
- Bufill, E., Agustí, J., Blesa, R., Agusti, J., and Blesa, R. (2011). Human neoteny revisited: The case of synaptic plasticity. Am J Hum Biol 23, 729–739.
- Petanjek Z, Judaš M, Šimic G, Rasin MR, Uylings HB, Rakic P, Kostovic I. (2011) Extraordinary neoteny of synaptic spines in the human prefrontal cortex. Proc Natl Acad Sci U S A. 2011 Aug 9;108(32):13281-6.
- Gould, S.J. (1992). Ontogeny and phylogeny–revisited and reunited. Bioessays.

Un avis sur « L’éloge de la lenteur »