Fabrication d’outils, du silex à l’Intelligence Artificielle. Peinture, des murs de la grotte de Cosquer aux noirs de Soulages. Abstraction, des théorèmes de Thalès à l’astronomie de Galilée. Le langage. La lignée humaine a augmenté ses capacités cognitives suite à la séparation entre les espèces de chimpanzés et les espèces humaines archaïques, il y a plus de 6 millions d’années. Le substrat de cette explosion cognitive est l’évolution du cerveau humain. La recherche des 40 dernières années a mis en évidence l’augmentation de la taille du cerveau humain et l’augmentation du nombre de neurones qui s’expliquent au cours du développement fœtal par une prolifération accrue des progéniteurs neuraux, les premières cellules du système nerveux qui donnent naissance aux neurones. En prenant l’analogie d’un ordinateur, les performances du cerveau humain sont accrues grâce à l’acquisition de nouveaux processeurs et à une plus grande complexité des microcircuits.
Quels sont les mécanismes moléculaires qui expliquent ses différences ? Tout d’abord, des mutations dans les régions non codantes du génome (c’est-à-dire qui ne correspondent pas à des gènes mais qui régulent l’expression des gènes) conduisent à une expression différentes des gènes dans les cellules humaines comparé aux autres espèces. Ensuite, par l’acquisition de nouveaux gènes et protéines, qui ne sont pas présents dans les génomes des autres espèces dont les autres primates. On parle de gènes dupliqués, spécifiquement humains.
Qu’en est-il de l’évolution des neurones eux-mêmes, l’unité de base et les cellules principales du cerveau humain ? Est-ce que leur physiologie diffère des neurones d’autres espèces ? Des travaux publiés depuis 2018 suggèrent que les mammifères partagent les mêmes types de neurones dans le cortex cérébral mais que leurs propriétés électriques diffèrent chez l’humain comparé aux neurones des autres mammifères. Ces travaux n’explicitaient cependant pas totalement les mécanismes moléculaires sous-jacents à ces différentes propriétés électriques.
Une étude publiée dans la revue scientifique Cell en décembre 2023, montre la production d’une nouvelle protéine récepteur dans les neurones humains qui modifie leurs propriétés électriques. C’est le premier exemple de l’acquisition d’une nouvelle protéine au cours de notre évolution récente ayant une fonction dans la physiologie des neurones de notre espèce. Ce travail est le fruit d’une collaboration entre des laboratoires de l’Université de Leuven (KU Leuven et UZ Leuven), du VIB (Vlaams Instituut voor Biotechnologie) et de l’Université libre de Bruxelles (ULB) en Belgique ainsi que de laboratoires de l’Université de Wellington (Nouvelle Zélande) et des Universités de Californie et du New Jersey (États-Unis). Il correspond en grande partie à 6 ans de mon travail de recherche post-doctoral à la KU Leuven, au VIB et à l’ULB, dans le laboratoire du Professeur Pierre Vanderhaeghen.
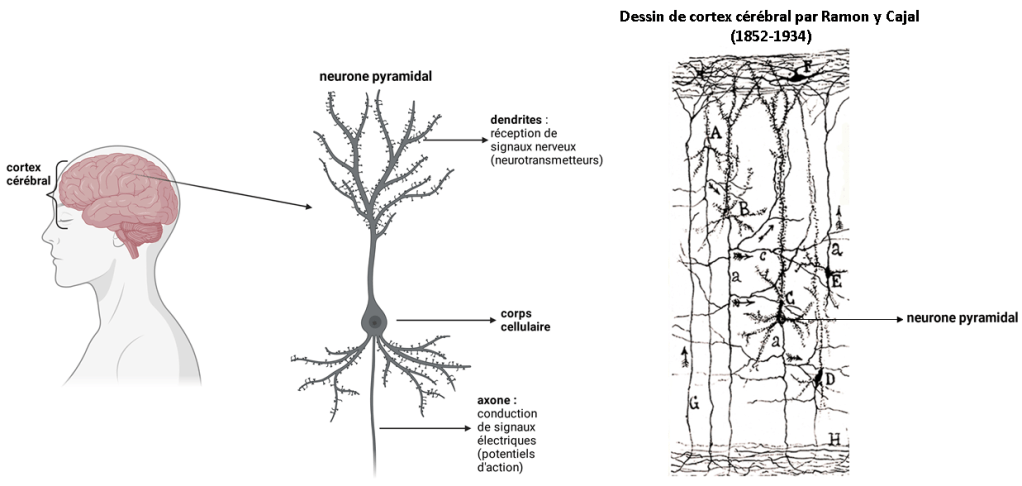
Figure 1 : Schéma d’un neurone pyramidal du cortex cérébral et dessin de cortex cérébral par Ramon y Cajal.
Qu’est-ce qu’un neurone ? Les neurones sont les cellules principales du système nerveux. Les neurones dont je parlerai ici sont les neurones du cortex cérébral, c’est-à-dire situés dans les régions cérébrales impliquées dans les processus sensoriels (vision, audition, mouvements moteurs) et cognitifs conscients. Ces neurones sont dit pyramidaux à cause de leur forme, décrite par le neuroscientifique espagnol Ramon y Cajal (1852-1934). Les neurones pyramidaux du cortex cérébral sont composés de trois parties : le corps cellulaire ou soma qui contient le noyau, les dendrites qui contiennent les synapses tels des antennes, et l’axone qui innerve d’autres neurones tel un câble téléphonique (Figure 1, voir aussi cette vidéo).

Figure 2 : La zone de gâchette est riche en canaux sodiques qui génèrent les potentiels d’action, c’est-à-dire les signaux électriques qui vont être conduits le long de l’axone. Les neurones humains (en rouge) sont moins excitables que les neurones des autres mammifères (en bleu) : ils produisent moins de potentiels d’action pour une même stimulation.
L’axone est un processus cellulaire ou fibre nerveuse qui part du soma et dont la longueur peut aller d’un millimètre à plus d’un mètre. C’est une structure neuronale clef dans la transmission d’information entre neurones. C’est en effet l’axone qui conduit des signaux électriques du soma jusqu’à à l’extrémité de l’axone où des neurotransmetteurs, molécules chimiques impliqués dans la communication entre neurones, seront relâchés à proximité des synapses d’autres neurones. Les signaux électriques sont appelés potentiels d’action. Les potentiels d’actions sont générés au début de l’axone au niveau d’une structure appelée le segment initial axonal ou zone de gâchette (Figure 2). L’appellation « zone de gâchette » illustre le rôle de cette zone : c’est elle qui génère les potentiels d’action, telle la gâchette d’une arme à feu, pour les « propulser » le long de l’axone.
On regroupe sous le contexte d’excitabilité neuronale la susceptibilité d’un neurone générer des potentiels d’action, la fréquence et la durée au cours de laquelle un neurone peut générer des potentiels d’action. Ces aspects sont clefs pour la transmission d’informations entre neurones dans des fonctions comme le langage. On peut imaginer des neurones se transmettant des informations relatives à des mots : il faut coder en signaux électriques des variations de fréquence, de tonalité, de syllabe. Or, il a été montré en 2018 et 2021 que les neurones pyramidaux du cortex cérébral humain sont beaucoup moins excitables que les neurones des autres mammifères (Figure 2).
Les mécanismes moléculaires, qui expliquent ce phénomène, sont très peu connus. Ils reposent nécessairement sur des molécules présentes dans les neurones humains et absentes dans les neurones des autres espèces. L’étude en question en a identifié une : la protéine récepteur LRRC37B.
Une nouvelle protéine dans les neurones humains : LRRC37B
Commençons par le génome humain, c’est-à-dire l’ensemble de l’information génétique présent dans le noyau de chacune de nos cellules, et hérités de nos deux parents biologiques. Il consiste en des molécules d’ADN organisées en pelotes, les fameux chromosomes. Une infime partie de la séquence d’ADN correspond à des gènes : l’espèce humaine en possède environ 22 000. Le corps d’un être humain contient environ 100 000 milliards de cellules, provenant toutes de la cellule-œuf, qui résulte de la fusion d’un spermatozoïde et d’un ovule. Elles ont donc toutes le même génome, c’est-à-dire les mêmes gènes. Cependant, tous les organes ne produisent pas les mêmes protéines, n’expriment pas les mêmes gènes, ce qui permet à des cellules cardiaque, rénale, neuronale par exemple d’avoir des fonctions différentes. Un gène est en effet, dans certaines cellules, transcrit en ARN messager qui lui-même est traduit en protéine. Ce sont les protéines qui participent ensuite à la biologie d’une cellule ou de l’organisme : elles peuvent constituer le squelette de la cellule ou d’un tissu, participer au métabolisme de la cellule, être sécrétées comme les hormones, ou encore être à la membrane de la cellule. Parmi ces dernières figurent les récepteurs qui se lient à des protéines extérieures à la cellules comme les hormones.
Il a été montré dans les années 2010 que le génome de notre espèce contient environ 53 familles de gènes qui sont soient absents chez les autres espèces animales, ou partagés avec les autres hominidés ou grands-singes (chimpanzés, bonobos, gorilles, orangs-outans) et absents chez les autres espèces dont d’autres primates (comme le macaque). On parle de gènes dupliqués spécifiques à l’humain ou aux hominidés. Parmi ces gènes, il a été montré en 2018 qu’au moins une trentaine sont exprimés au cours du développement du cortex cérébral humain. Parmi ceux-ci figure le gène codant pour la protéine membranaire LRRC37B : il est présent dans les génomes des humains et des autres hominidés (Figure 3).

Figure 3 : Le génome des grands-singes ou hominidés (humain, chimpanzé, bonobo, gorille, orang-outan) code pour la protéine membranaire LRRC37B. Ce gène n’existe pas chez les autres espèces dont les autres primates (macaque, marmouset, lémur, cercopithèque ascagne, babouin, etc).
Ensuite, nous nous sommes demandés où la protéine LRRC37B est localisée dans le cortex cérébral humain. Nous avons détecté LRRC37B chez l’humain au niveau de la zone de gâchette. Nous ne l’avons pas détecté dans le cortex cérébral de souris ou de macaque, ce qui était attendu étant donné que ces espèces ne possèdent pas le gène dans leur génome. En revanche, de manière plus surprenante, nous n’avons pas détecté LRRC37B au niveau de la zone de gâchette dans le cortex cérébral de chimpanzé (Figure 4). Cela montre que des mécanismes encore à explorer ont permis la production et la localisation de LRRC37B spécifiquement chez l’humain comparé aux autres grands singes ou hominidés.

Figure 4 : LRRC37B est localisé au niveau du segment initial axonal des neurones pyramidaux du cortex cérébral chez l’humain mais pas chez le chimpanzé, le macaque ni la souris. @Libé-Philippot et al., Cell
De manière intéressante, LRRC37B était indétectable dans des tissus d’autopsies de nouveaux-nés, sa production augmente avec l’âge pour atteindre une expression stable à partir de l’adolescence tout au cours de la vie (Figure 5). Cette expression tardive n’a pas simplifié l’étude de la fonction de LRRC37B : les modèles actuels in vitro (organoïdes cérébraux, neurones différentiés à partir de cellules pluripotentes) ne permettaient pas d’étudier le rôle de LRRC37B.
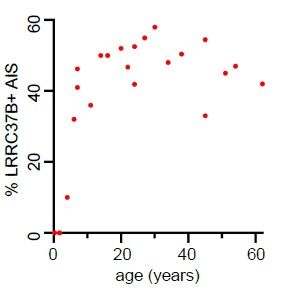
Figure 5 : Proportion de zones de gâchettes qui sont positives pour LRRC37B au cours de la vie. LRRC37B commence à s’exprimer au cours de l’enfance, pour atteindre une expression stable à partir de l’adolescence et ce, pour le reste de la vie. @Libé-Philippot et al., Cell
Un nouveau modulateur de l’excitabilité neuronale chez l’humain
Étant donné que LRRC37B est localisé au niveau de la zone de gâchette, nous nous sommes demandé si LRRC37B influençait l’excitabilité neuronale, étant donné qu’elle est diminuée chez l’humain. Pour répondre à cette question, nous avons ajouté LRRC37B dans les neurones de souris : cela diminuait leur excitabilité ! Puis nous avons mesuré l’excitabilité de neurones pyramidaux humains, à partir de biopsies obtenues lors de chirurgies dans un hôpital pour traiter des épilepsies, et obtenues après consentement des patients. Les neurones qui produisent LRRC37B sont moins excitables que les neurones qui ne l’expriment pas (Figure 6) !

Figure 6 : B-C, Exemples de neurones pyramidaux du cortex cérébral humain (en vert) qui expriment ou non LRRC37B (en magenta). D, Exemples de potentiels d’actions (signaux électriques). E, Les neurones qui produisent LRRC37B sont moins excitables que les neurones qui ne l’expriment pas. @Libé-Philippot et al., Cell
Une nouvelle voie moléculaire dans les neurones humains
Jusqu’à ce jour, LRRC37B était un récepteur orphelin, c’est-à-dire que personne n’avait cherché ou trouvé les molécules qui se lient au récepteur. Par plusieurs approchent indépendantes, nous avons identifié deux molécules qui se lient à LRRC37B : une protéine sécrétée (FGF13A) et une autre protéine membranaire (SCN1B). Ces deux protéines agissent sur les canaux sodiques de la zone de gâchette (Figure 7) !
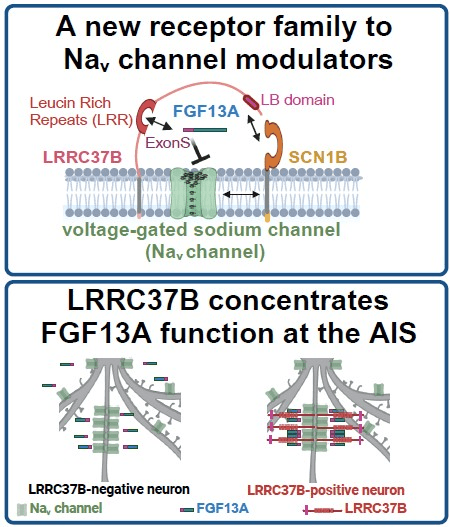
Figure 7 : LRRC37B se lie à la protéine sécrétée FGF13A et à la protéine membranaire SCN1B. Ces deux dernières agissent sur les canaux sodiques (Nav) de la zone de gâchette. LRRC37B concentre FGF13A au niveau du segment initial axonal ce qui inhibe les canaux sodiques et donc diminue l’excitabilité neuronale. @Libé-Philippot et al., Cell
Vers une meilleure compréhension des fonctions des circuits neuraux humains et de leurs pathologies
Intéressant, mais quelle est la conséquence à l’échelle comportementale de l’acquisition de LRRC37B par la zone de gâchette des neurones humains ? De futurs travaux permettront de répondre à cette question. Cependant, nous avons des hypothèses. Par exemple, une étude publiée en 2022 montrait que les circuits de neurones du cortex cérébral auditif, impliqué dans le langage, prenaient plus de temps chez l’humain pour traiter les informations auditives comparé aux circuits de chimpanzé ou de macaque. Un traitement plus lent de l’information nécessite de générer des potentiels d’action sur de longues périodes. Cela n’est possible que si l’excitabilité neuronale est faible. En effet, lorsque de nombreux potentiels d’actions sont générés à haute fréquence (chez la souris par exemple), les neurones fatiguent rapidement et ne peuvent générer de potentiels d’action sur de longues périodes. Une participation de LRRC37B à l’acquisition du langage ? Une hypothèse à explorer.
De manière intrigante, FGF13A, SCN1B et les canaux sodiques (Nav) sont impliqués dans des maladies neurales telle que l’épilepsie ou l’autisme. Notre travail suggère donc que l’espèce humaine pourrait disposer d’une sensibilité particulière à certaines épilepsies ou certaines formes d’autisme, impliquant LRRC37B. Par ailleurs, de futurs travaux pourraient permettre d’identifier de nouvelles molécules pour diminuer l’excitabilité neuronale, qui est accrue pendant une crise d’épilepsie, notamment en modulant l’interaction entre LRRC37B et FGF13A.
En conclusion, notre travail a révélé la présence d’un nouveau récepteur membranaire dans les neurones pyramidaux du cortex cérébral chez l’humain. Ce récepteur, via FGF13A et SCN1B, agit sur les canaux sodique de la zone de gâchette en diminuant l’excitabilité neuronale. Il s’agit du premier exemple d’une protéine acquise au cours de l’évolution de la lignée humaine et la physiologie des neurones humains. Ces résultats sont une porte d’entrée vers l’étude de l’évolution des circuits neuraux humains, substrat de l’évolution de nos capacités cognitives, et de leurs pathologies telle que l’épilepsie et l’autisme. Ce travail n’aurait pas pu être possible sans l’expérimentation animale (modèle de souris), ni des tissues de cortex cérébral de primates (chimpanzé, macaque). Il n’aurait pas été possible non plus sans le consentement éclairé d’individus qui ont permis des études sur du tissu cérébral humain. Enfin, des financements de l’Union Européenne et des Agences ou Fondations belges ont financé ce travail (le programme EOS/FWO, le FWO, le fonds Generet, la Fondation Médicale Reine Élisabeth).
Plus sur cette découverte :
Source :
Article d’origine : Baptiste Libé-Philippot, Amélie Lejeune, Keimpe Wierda, Nikolaos Louros, Emir Erkol, Ine Vlaeminck, Sofie Beckers, Vaiva Gaspariunaite, Angéline Bilheu, Katerina Konstantoulea , Hajnalka Nyitrai, Matthias De Vleeschouwer, Kristel M. Vennekens, Niels Vidal, Thomas W. Bird, Daniela C Soto, Tom Jaspers, Maarten Dewilde, Megan Y Dennis, Frederic Rousseau, Davide Comoletti, Joost Schymkowitz, Tom Theys, Joris de Wit, and Pierre Vanderhaeghen (2023) LRRC37B is a human modifier of voltage-gated sodium channels and axon excitability in cortical neurons, Cell 2023 Dec 21; 186 1-17, DOI: https://www.sciencedirect.com/science/article/pii/S0092867423013144
Nikolas L. Jorstad et al. (2023) Comparative transcriptomics reveals human-specific cortical features, Science 2023 Oct 13;382(6667):eade9516
Kosuke Itoh et al. (2022) Cerebral cortical processing time is elongated in human brain evolution, Sci Rep. 2022 Jan 20;12(1):1103
Baptiste Libé-Philippot & Pierre Vanderhaeghen (2021) Cellular and Molecular Mechanisms Linking Human Cortical Development and Evolution, Annual Review of Genetics 2021 Nov 23:55:555-581
Lou Beaulieu-Laroche et al. (2021) Allometric rules for mammalian cortical layer 5 neuron biophysics, Nature 2021 Dec;600(7888):274-278
Rebecca D. Hodge et al. (2019) Conserved cell types with divergent features in human versus mouse cortex, Nature 2019 Sep;573(7772):61-68
Ikuo K. Suzuki et al. (2018) Human-Specific NOTCH2NL Genes Expand Cortical Neurogenesis through Delta/Notch Regulation, Cell 2018 May 31;173(6):1370-1384.e16
Brian E. Kalmbach et al. (2018) h-Channels Contribute to Divergent Intrinsic Membrane Properties of Supragranular Pyramidal Neurons in Human versus Mouse Cerebral Cortex, Neuron 2018 Dec 5;100(5):1194-1208.e5
Lou Beaulieu-Laroche et al. (2018) Enhanced Dendritic Compartmentalization in Human Cortical Neurons, Cell 2018 Oct 18;175(3):643-651.e14
Giuliana Giannuzzi et al. (2013) Evolutionary dynamism of the primate LRRC37 gene family, Genome Res, 2013 Jan;23(1):46-59
Peter H. Sudmant et al. (2010) Diversity of Human Copy Number Variation and Multicopy Genes, Science. 2010 Oct 29;330(6004):641-6
Ramon y Cajal, Histologie du systéme nerveux de l’homme et des vertebrés, 1901
Figures générées à partir de Biorender.com

Un avis sur « Une nouvelle voie moléculaire à la zone de gâchette des neurones humains »